Essais cliniques – 6 mois
L'innocuité et l'efficacité de LUNESTA (3 mg) ont été évaluées dans le cadre d'une étude à répartition aléatoire, à double insu, contrôlée par placebo, d'une durée de 6 mois, menée auprès d'adultes âgés de moins de 65 ans (N = 828).
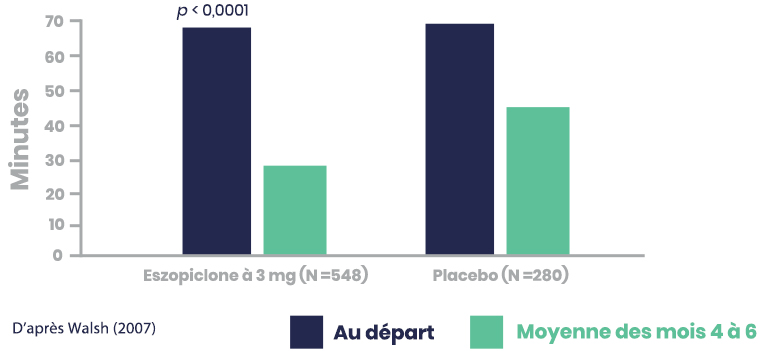
LUNESTA a aidé les patients à s'endormir plus rapidement que le placebo selon la mesure subjective de la latence avant le sommeil signalée par les patients
Critère d'évaluation principal : LUNESTA (3 mg) s'est avéré supérieur au placebo pour réduire la latence avant le sommeil (LS) signalée par les patients (moyenne des mois 4 à 6)1,2
Latence avant le sommeil (min) signalée par les patients avec LUNESTA (3 mg) p/r au placebo*
LUNESTA a réduit la durée d'éveil après l'endormissement (DÉAE) par rapport au placebo
Critère d'évaluation secondaire : LUNESTA (3 mg) a significativement amélioré la DÉAE signalée par les patients par rapport au placebo (moyenne des mois 4 à 6)1,2
DÉAE (min) signalée par les patients avec LUNESTA (3 mg) p/r au placebo*

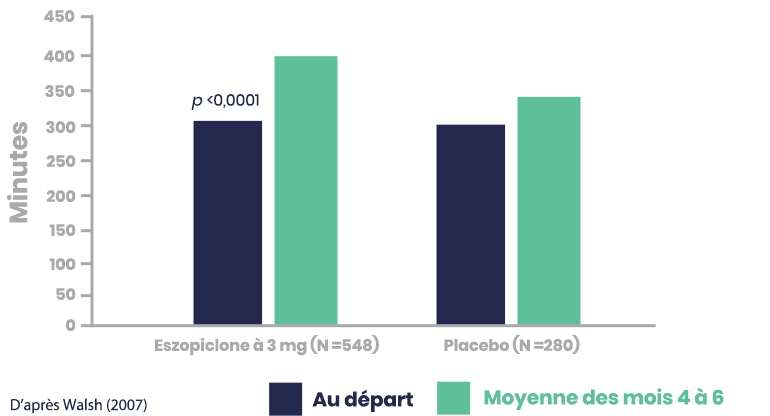
LUNESTA a augmenté la durée totale du sommeil par rapport au placebo
Critère d'évaluation secondaire : LUNESTA (3 mg) a significativement amélioré la DTS signalée par les patients par rapport au placebo (moyenne des mois 4 à 6)1,2
DTS (min) signalée par les patients avec LUNESTA (3 mg) p/r au placebo*
La dose initiale recommandée est de 1 mg. La dose peut être augmentée à 2 mg ou 3 mg si cela est cliniquement indiqué. Il faut utiliser la dose efficace de LUNESTA la plus faible possible chez chaque patient.